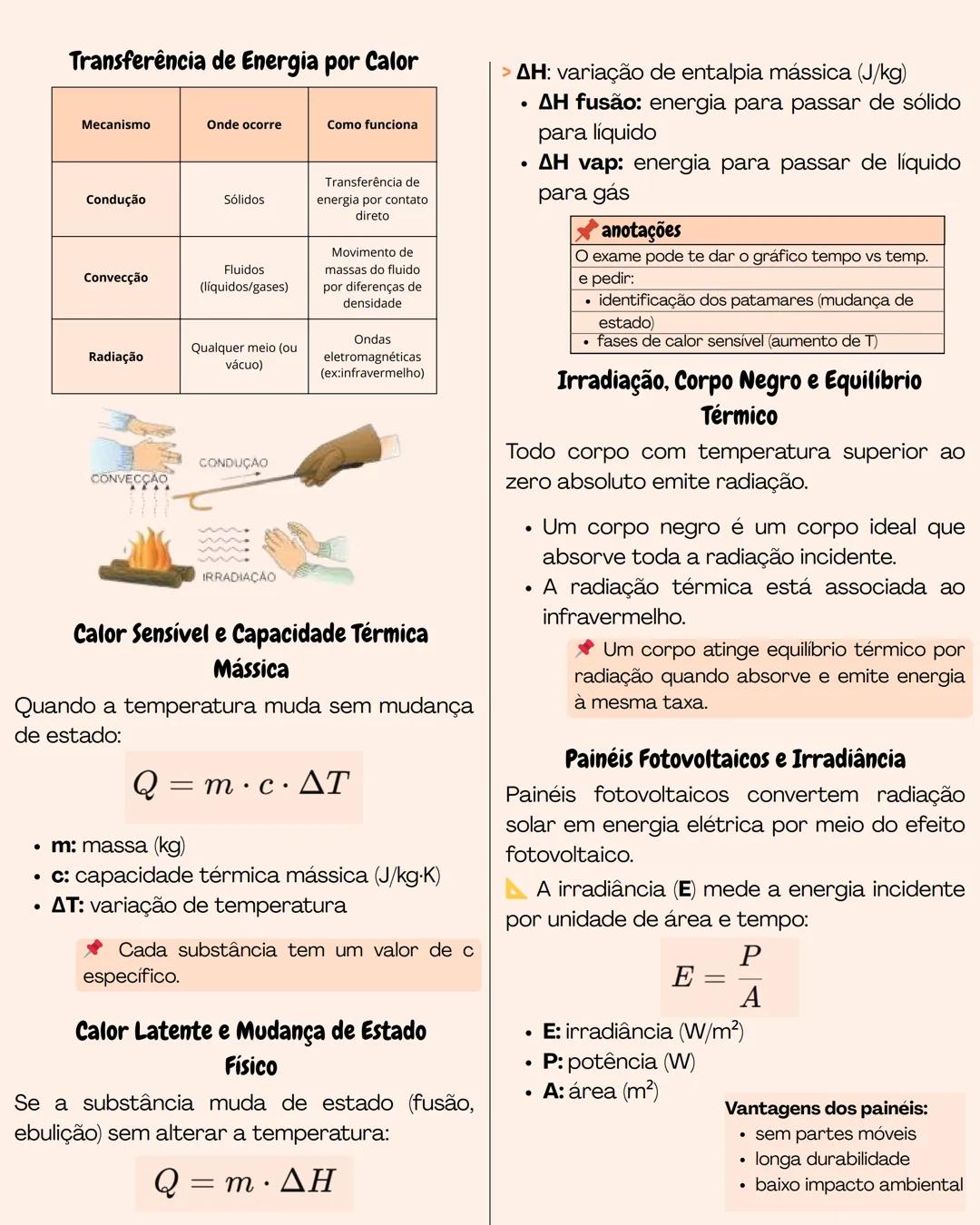
Sistema Termodinâmico e Energia Interna
Um sistema termodinâmico é uma porção de matéria delimitada onde se estuda a variação de energia. Existem três tipos principais: isolados (sem trocas), fechados (trocam energia, mas não matéria) e abertos (trocam energia e matéria).
A energia interna (U) de um sistema é a soma da energia cinética microscópica (movimento das partículas) e energia potencial microscópica (ligações intermoleculares). Quanto maior a temperatura, maior a agitação das partículas e sua energia cinética média.
A temperatura é uma medida do nível de energia cinética média das partículas. Dois corpos estão em equilíbrio térmico quando têm a mesma temperatura, princípio conhecido como o princípio zero da termodinâmica. As escalas mais comuns são Celsius (°C) e Kelvin (K), relacionadas por T(K) = T(°C) + 273,15.
Dica para o exame: A Primeira Lei da Termodinâmica estabelece que ΔU = Q + W, onde ΔU é a variação da energia interna, Q é o calor trocado e W é o trabalho realizado. Se Q e W são positivos, a energia interna aumenta; se algum deles for negativo, ela pode diminuir.
A Segunda Lei da Termodinâmica diz que os processos espontâneos ocorrem no sentido da diminuição da energia útil. Transformações irreversíveis, como atrito, levam à degradação da energia disponível.